
近日,伟德1949官网研究生导师侯君团队在中国化学会主办、中国医学科学院药物研究所承办的中科院Q1区SCI刊物Chinese Chemical Letters(IF:8.455)发表题为“Erythrocyte membrane encapsulated gambogic acid nanoparticles as a therapeutic for hepatocellular carcinoma”的研究。
藤黄酸是一种具有多种抗肿瘤活性的中药提取物,但其极低的水溶性及较短的半衰期限制了其临床使用,在这项工作中,将天然红细胞膜与可降解聚合材料相结合构建了一种新的负载藤黄酸的仿生纳米载药系统,并对其进行了一系列物理表征,包括粒子形态的观察,粒径和电位的测量,考察了仿生纳米制剂在低温保存下的稳定性以及其在生理PH溶液和酸性缓冲溶液中的释放度。随后该文章考察了其体外的生物相容性及抗肝癌细胞活性。最后,此文章进一步探究其在荷瘤小鼠体内的抗肿瘤活性及全身用药安全性。研究结果表明,该仿生纳米制剂具有良好的物理特征和稳定性,并在体外可有效延缓药物的释放,对血液、正常肝细胞及小鼠主要脏器具有可靠的安全性,展现出良好的抗肿瘤活性,值得更深入的实验去检测其控释效果。论文通讯作者为伟德1949官网硕士生导师侯君,四川省人民医院药学部师健友研究员和白兰副主任药师为该论文共同通讯作者。第一作者为伟德源自英国始于1946伟德1949官网硕士研究生刘瑞杰,共同第一作者为成都中医药大学药学院硕士研究生何利。
肝癌是人类第四大癌症死亡原因,肝细胞性肝癌(hepatocellular carcinoma,HCC) 在其病例中占比较高,是其主要亚型。现有抗晚期肝癌药物的毒副作用明显,服药患者出现腹泻、皮肤病、厌食、脱发等多种不良反应。因此,开发新的抗晚期肝癌的药物迫在眉睫。 藤黄酸(gambogic acid,GA)为藤黄中主要活性物质之一,早已发现 GA有抗肝癌等移植性肿瘤活性。经过多年的抗肿瘤研究发现,GA为广谱抗癌物质,对肝癌、肺癌、胃癌、乳腺癌和结肠癌等均有良好的活性,并具有良好的安全性。然而,GA水中的溶解度低,半衰期短,为此药物研究者研制了一系列纳米制剂,包括纳米粒、胶束和脂质体等以期增强藤黄酸在体内的稳定性和滞留时间从而增强其抗癌活性。此外,红细胞(red blood cells,RBCs)作为血液中最丰富的长循环细胞,具有天然生物相容性、生物可降解性和长循环半衰期等特点,已被广泛用于药物输送系统。因此,由红细胞膜与纳米材料相结合伪装成的仿生纳米颗粒逐渐成为药物制剂的热点平台。
要点1:仿生纳米粒的构建及物理表征
该文章采用薄膜分散法成功制备了载药无膜纳米粒GPP-NPs,而后通过物理挤压法将红细胞膜与GPP-NPs混合反复挤出制备仿生纳米制剂RBC@GPP-NPs。粒径仪及透射电镜检测结果表明此两种纳米制剂为均匀分散的颗粒状,粒径分别为102.3±3.1 nm(图1A和C)和89.55±0.92 nm(图1B和D),RBC@GPP-NPs 直径的增加大约等于 RBCM的厚度(图1C和E)。此外,RBC@GPP-NPs和GPP-NPs具有较高的包封率,分别为(79.11±1.42)%和(86.37±0.84)%,表明仿生纳米制剂可以有效地包裹药物。
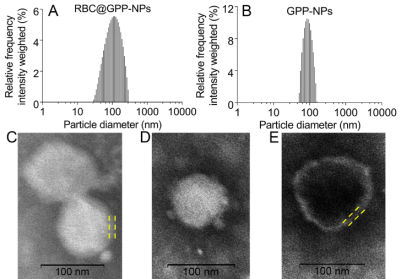
图1. 仿生纳米制剂形态大小表征
要点2:仿生纳米粒的稳定性、体外释药行为及安全性考察
仿生纳米制剂的稳定性强于无膜纳米,且其缓释性能好,在肿瘤生长酸性环境中释放度高于无膜纳米制剂。研究结果如图2A所示,在第6天,RBC@GPP-NPs的平均粒径从98.35 nm增加到100.06 nm,增加量为1.71 nm, GPP-NPs的平均粒径从85.01 nm增加到89.7 nm,增加量为4.69 nm,这表明两种制剂在6天内都是稳定的,但仿生纳米制剂表现更好。16天后,两者的增量均小于7 nm。此外,两组PDI值在第6天后趋近于0.15,表明两种制剂均具有良好的分散性。在中性PBS(pH 7.4)中(图2B),RBC@GPP-NPs的GA最大累积释放率约为36.62%,低于GPP-NPs的41.44%。而在酸性介质(pH 5.5)中(图3C),RBC@GPP-NPs的GA最大累积释放率增加到53.25%,仍低于GPP-NPs的药物累积释放度(62.96%)。这些结果表明,仿生纳米制剂具有保持体内有效药物浓度的潜力。
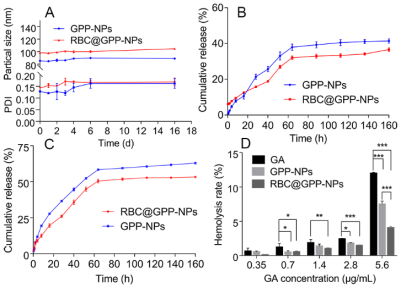
图2. 仿生纳米制剂稳定性与释药过程表征
要点3:仿生纳米粒的体外抗肿瘤活性及安全性评价
体外抗肿瘤实验结果显示,在24小时和48小时的培养后,所有药剂都被检测出对HepG2细胞具有剂量和时间依赖的细胞毒性。在给药24小时后,有利药物和纳米制剂对HepG2细胞活力的影响没有显著区别(图3A)。但当GA浓度为0.35-1.4 μg/mL时,RBC@GPP-NPs的细胞活力从90%迅速下降到30%(图3B),是其他两组的两倍。这可能是由于仿生纳米制剂起到了缓释控释效果。
另外,纳米制剂和游离药物对正常细胞的细胞毒性结果表明,与游离药物组相比,纳米制剂对正常细胞的毒性都有降低,且仿生纳米制剂毒性最小。24小时后,在低浓度下(0.35 - 2.8 μg/mL),仿生纳米制剂对正常细胞的抑制率几乎为零,无膜纳米制剂次之(图3C);48小时后,低浓度下RBC@GPP-NPs的细胞存活率明显高于GPP-NPs和游离GA组(图3D),说明仿生纳米制剂可降低药物对正常组织的毒性。
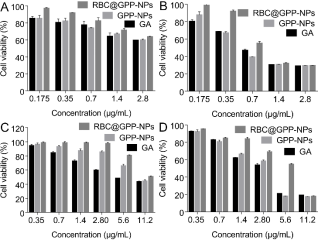
图3. 仿生纳米制剂抗体外抗肿瘤活性及安全性评价
要点4:仿生纳米粒的体内抗肿瘤活性评价
体内实验结果表明仿生纳米制剂可有效减缓肿瘤的生长速度(图4)。所有实验组中,仿生纳米制剂组肿瘤体积增长最慢,平均体积为715 mm3,与生理盐水相比具有显著性差异(图4C),其抗肿瘤作用的增强可能是由于仿生纳米颗粒增加了小鼠体内药物的循环时间。此外,H&E染色结果表明与无膜纳米制剂GPP-NPs组和游离药物组相比,仿生纳米制剂RBC@GPP-NPs表导致肿瘤组织中最广泛的肿瘤组织凋亡(图4D)。这些结果表明RBC@GPP-NPs可抑制肿瘤细胞HepG2的生长。体内安全性实验表明两种纳米制剂、游离药物组和生理盐水组小鼠体重无显著差异及各组主要脏器系数均正常,表明仿生纳米制剂具有较高的安全性。
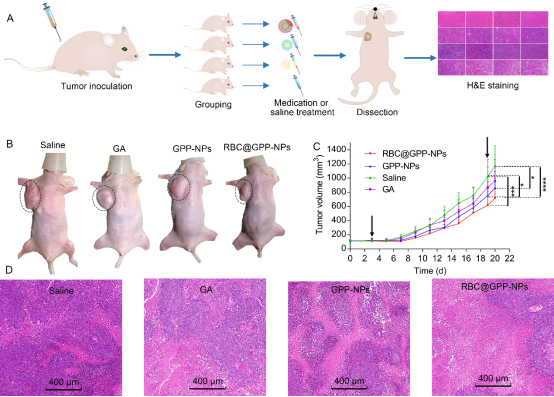
图4. 仿生纳米制剂体内抗肿瘤评价
全文链接:https://doi.org/10.1016/j.cclet.2022.05.089
 4007-200-518
4007-200-518
 关注伟德源自英国始于1946
关注伟德源自英国始于1946



