Advanced Materials是国际知名期刊,其发文涵盖了纳米材料、生物材料、材料物理、材料化学、工程材料等领域,接收相关领域的顶尖科研成果。目前,其影响因子为32.086。
近年来,周绍兵教授团队一直致力于高分子纳米药物载体材料的研究,取得了多项重要成果,对恶性肿瘤等重大疾病在动物实验研究上表现出优异的治疗效果。团队已在Advanced Materials, Science Advances, Progress in Polymer Science等国际高影响期刊发表文章200余篇,文章他引10000余次,获得发明专利30项。相关研究成果正与多家企业合作,以推进临床转化。
癌症免疫治疗正转向如何更有效地激活免疫系统来消灭癌细胞。目前的免疫治疗调控策略主要包括极化免疫细胞表型,免疫检查点封锁,新抗原呈递,工程T细胞和细胞因子治疗等。尽管在某些情况下,它们在临床前或临床研究中有一定的效果,但肿瘤细胞的免疫逃逸和免疫抑制微环境仍会对这些策略疗效产生很大限制。考虑到肿瘤微环境(TME)是肿瘤细胞增殖和转移的生态位,酸性的肿瘤微环境可以阻碍抗原提呈细胞的成熟和淋巴细胞的激活,从而形成免疫抑制微环境。因此,重塑酸性TME对缓解免疫抑制具有重要意义。
对此,伟德源自英国始于1946周绍兵教授团队开发了一种具有多级结构的电纺纤维装置作为局部药物递送系统,用于重塑酸性肿瘤微环境(TME),以提高免疫疗法的治疗效果(图1)。纤维基质中的质子泵抑制剂(PPIs)持续释放以抑制肿瘤细胞内H+的外排,重塑酸性TME。纤维内腔中的靶向胶束和M1巨噬细胞膜包被的纳米颗粒可分别诱导肿瘤细胞的免疫原性细胞死亡 (ICD) 和肿瘤相关巨噬细胞 (TAM) 的表型转化。TME中酸度的缓解进一步促进了ICD和TAM的极化,缓解了免疫抑制微环境并协同增强了抗肿瘤免疫反应。
体内实验表明,PPIs从纤维基质中持续释放,可抑制肿瘤细胞V-ATPase活性,将酸性TME中和至~7.2,有效缓解TME的免疫抑制,其中Tregs和MDSCs的比例分别下降11.1%和14.2%。DOX@M诱导原位ICD效应和R837@MPs介导的肿瘤相关巨噬细胞表型转化,激活更有效的抗原特异性抗肿瘤免疫应答,肿瘤杀伤免疫细胞因子(IL-6、IL-12和TNF-α)和免疫记忆细胞TCM的比例增多,小鼠4T1肿瘤抑制率达97%,能够有效抑制肿瘤转移。同时,将该多级结构载药纤维装置用于治疗小鼠高转移性肿瘤B16-F10和结肠癌CT26模型,发现同样能够增强小鼠体内抗肿瘤免疫反应,抑制肿瘤的生长,延长小鼠生存率。因此,该植入式纤维装置在高转移性肿瘤的治疗中具有很大的应用潜力。
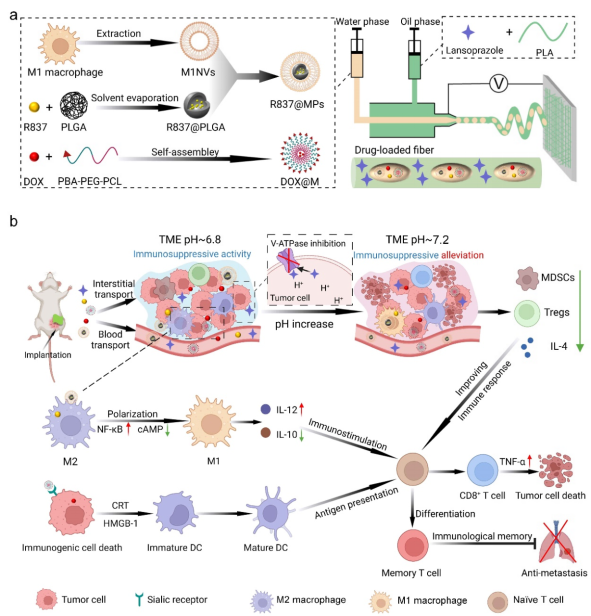
图1.纤维装置的制备、局部酸性肿瘤微环境(TME)重塑和抗肿瘤免疫激活的示意图。
a.装载LPZ、DOX@M胶束和R837@MPs的多级结构电纺纤维的制备。b.局部酸性TME重塑机制及免疫治疗过程。
以上成果发表在Advanced Materials(10.1002/adma.202300216)上。论文的第一作者为伟德1949官网(生物医学工程研究院)博士研究生李艳,伟德1949官网(生物医学工程研究院)杨光副研究员和周绍兵教授为共同通讯作者。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202300216